प्रकरण ३ - अलौकिक गुणांचे पाणी
प्रकरण ३ - अलौकिक गुणांचे पाणी
पाऱ्याचा जीवनाशी असलेला अतुट संबंध बघितल्यानंतर ज्या गुणांच्या बळावर पाण्याने हे अनन्यसाधारणत्व कमाविले त्या भौतिक व रासायनिक गुणांचा अधिक सखोल अभ्यास करण्याची इच्छा साहजिकच बळावते.
पाण्याच्या विशेष गुणधर्मांचा अभ्यास करण्यापूर्वी 'स्थितप्रज्ञ दिसे कैसा ' हे जसे जाणून घेतले जाते तसेच जीवनावर प्रचंड प्रमाणात प्रभाव गाजविणारा पाण्याचा रेणू असतो तरी कसा, हे समजावून घेतलं तर पुढील गोष्टी समजणे अधिक सुलभ होईल.
पाण्याचा रेणू:
पाण्याचा रेणू तीन मूल-घटक-तत्त्वांपासून किवा तीन अणूंच्यापासून तयार होतो. दोन हैड्रोजन व एक ऑक्सिजनचा असे तीन अणू एकत्र येऊन पाण्याचा रेणू तयार होतो. सूत्र-रूपाने तो H2O असा अभिव्यक्त केला जातो. हे तीन अणू रासायनिक बंधांच्या द्वारा एकत्रित आणले जातात. हैड्रोजनचे दोन अणू आपल्याजवळील एकेका इलेक्ट्रॉनची ऑक्सिजनच्या अणूच्या बाहेरील ऊर्जास्तरात असलेल्या सहा इलेक्ट्रॉनांच्या बरोबर भागीदारी करून तीन्हीही अणूंना सामावून घेणाऱ्या बाहेरील किवा अंतीम ऊर्जास्तरातील' (काल्पनिक) इलेक्ट्रॉनांची संपृकक्तावस्था' प्राप्त करून घेतात व' अशाप्रकारे एक रासायनिक बंध तयार होतो. पाण्याच्या संबंधात तयार झालेल्या या विशिष्ट बंधास सहसंयोजक बंध असे म्हणतात.
(आकृती ३.१).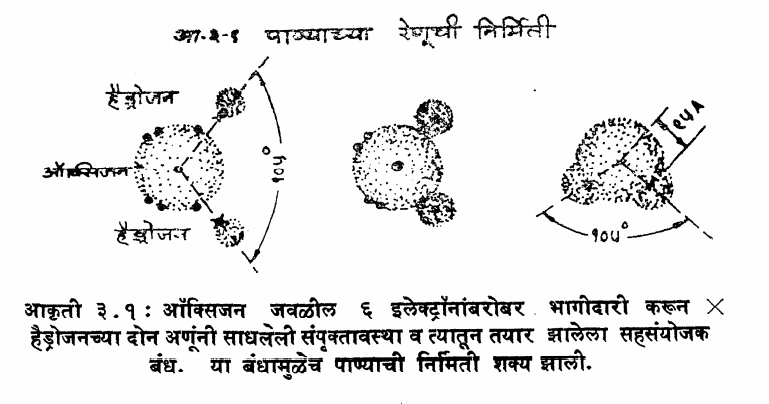
हैड्रोजन बंध:
पाण्याचा एक रेणू हे जरी शास्त्रीय सत्य असले तरी प्रत्यक्षात असा एक रेणू बाजूला काढून दाखविणे किंवा त्यांचा अभ्यास करणे फारच कठीण आहे. समष्टीजीवनात संपूर्णतया विलीन होऊन गेलेले व्यष्टीजीवन कसे असते हे दाखविण्यास पाण्याच्या रेणूविना अन्य उपमान सापडणे कठीण आहे. प्रत्यक्षात आपण बघतो ते पाणी म्हणजे अगणित रेणूंचा एकजीव झालेला असा एक समूह असतो. असंख्य रेणूंना एकत्रित आणून संपूर्ण जलाशय म्हणजे जणू कांही एकाच रेणूने व्यापून राहिलेला साठा असा आभास ज्या एका विशिष्ट रेणूबंधामुळे निर्माण होतो त्यास हैड्रोजन बंध असे म्हणतात.
पाण्याच्या एका रेणूमध्ये ऑक्सिजनच्या व एका अणूला दोन हैड्रोजनचे अणू जोडलेले असतात. पाण्याचे वैशिष्ट्य असे की, हे रेणू तुटक वृत्तीचे नसल्याने आजुबाजूच्या रेणूंबरोबर जवळीक निर्माण करू पाहतात. एका रेणूतील ऑक्सिजनचा अणू जवळच्या पाण्यातील दोन रेणूंमधील' हैड्रोजन अणूंच्या बरोबर बंध निर्माण करून त्यांना आपल्या जवळ आणतात. या बंध निर्माण करण्याच्या क्रियेत हैड्रोजनचा वाटा बराच असल्यामुळे या बंधास हैड्रोजन बंध असे नाव देण्यात आले आहे. (आकृती ३.२).
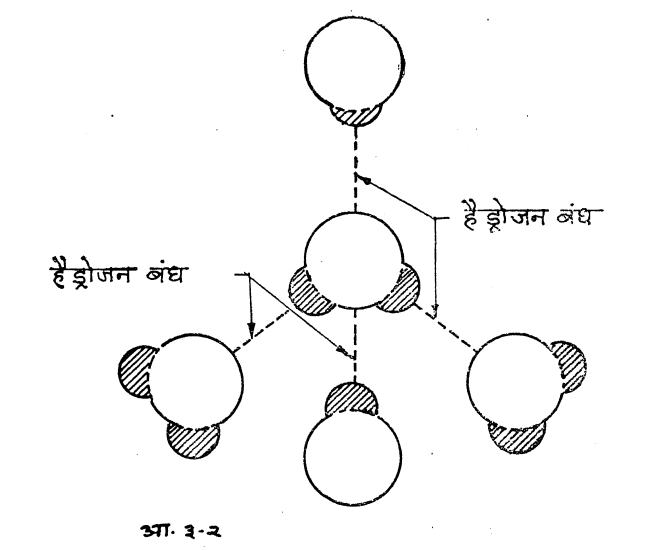
मात्र हा बंध फार जोरदार स्वरूपाचा नसल्याने पाण्याच्या रेणूंची आपसातील हालचाल पूर्णपणे (घनपदार्थाप्रमाणे) नष्ट होत नाही वा वायूप्रमाणे अनियंत्रितही होत नाही. ती नियंत्रित हालचाल असल्यामुळेच पाण्याचे निसर्गसिद्ध स्वरूप द्रवस्थितीत असल्याचे आढळते. सर्वसाधारण परिस्थितीत बहुतांशी द्रवस्थितीत असले तरी थोडेसे पाणी वाफेच्या स्वरूपातही हवेमध्ये नेहमीच आढळते.
हैड्रोजनचे दोन अणू ऑक्सिजनच्या एका अणूबरोबर जेव्हा इलेक्ट्रॉनीय भागीदारी करतात, त्यावेळी ऑक्सिजन'चा ऋणविधुतू-भार हैड्रोजनच्या कणविंद्युत्भारापेक्षा अधिक असल्याने हैड़ोजन अणूंनी भागीदारीसाठी देऊ केलेले इलेक्ट्रॉन आपल्याकडे खेचून घेतात. परिणामत: हैड्रोजनमधील' प्रोटॉन एकाकी नि उघडा पडतो. एकाकी प्रोटॉन-धनात्मक भार, पाण्याच्या दुसर्या रेणूतील ऑक्सिजन अणूच्या इलेक्ट्रॉनला (हैड्रोजनबरोबर भागीदारी न केलेल्या) आकर्षित करण्याचा प्रयत्न करतो. पाण्याच्या रेणूतील ऑक्सिजन अणूपाशी सहसंयोजक बंधात न फसलेले असे चार इलेक्ट्रॉन असतात. हे चारीही इलेक्ट्रॉन आकृती ३-२ मध्ये दाखविल्याप्रमाणे चार हैड्रोजन बंध निर्माण करून पाण्याच्या चार रेणूंना एकत्र आणतात. या बंधामुळे पाण्याचे अलौकिक गुणधर्म समजण्यास मदत होते.
हा हैड्रोजन बंध 'आयनिक' वा 'सह्संयोजक' बंधापेक्षा कमी सामर्थ्यशाली असला तरी दोन समान अणूंमध्ये नेहमी वसत असलेल्या ' व्हॅन-डर-वॉल्स ' च्या आकर्षण-बलापेक्षा अधिक सामर्थ्यशाली असतो.
हैड्रोजन बंधामुळे एकव आलेले पाण्याचे दोन रेणू, पाण्याला उच्च-उष्णता-अवधारकता ,'बर्फाच्या संकलनाची उच्च अप्रकट उष्णता ', ' बाष्पताची उच्च अप्रकट उष्णता 'संसंजन' व 'आसंजन ' यासारखे गुणधर्म मिळवून देण्यास कारणीभूत होतात. पाण्याच्या रेणूंमधील' हैड्रोजन व ऑक्सिजन यांच्या अणूंवर असलेल्या विशिष्ट विद्युत भारांमुळें पाण्याला, ' वियुतूक्षेत्राचे उदासिनीकरण ' करण्याचे सामर्थ्य प्राप्त झाले आहे. याप्रमाणेच पाण्याला प्राप्त झालेला उच्च 'विद्युत अपार्यता स्थिरांक ' हाही या विद्युत-भारांचाच परिणाम आहे. पाण्याजवळ असलेली ' सर्वव्यापी विलायक शक्ती ' हा गुणदेखील त्यांच्यामुळेच निर्माण होऊ शकला. या सार्या गुणांची चर्चा या प्रकरणात केली आहे.
Hits: 824